科学家开发第二代CAR-巨噬细胞,与化疗联用或达更佳疗效
针对实体肿瘤的免疫细胞治疗面临着系列挑战,由于实体肿瘤自身的物理屏障,T 细胞等难以对其实现浸润。
另一方面,实体肿瘤往往具有高度异质性,以往的技术手段(例如 CAR-T)只能杀伤部分实体肿瘤中的细胞,而逃逸的部分细胞可能会形成转移病灶,因此治疗效果十分有限。
实体肿瘤中包含了大量的血液细胞,其中,巨噬细胞(Macrophages) 在人体组织和实体肿瘤里分布广泛,在某些瘤种中占浸润血液细胞的比例可高达 40-50%,并在很多疾病或病理条件下发挥着重要的作用。
那么,是否可以利用巨噬细胞,在实体肿瘤中作为新型细胞治疗的药物,让它同时具备抗原依赖性和非抗原依赖性杀伤的特性呢?
 图丨Nature Immunology 当期封面(来源:Nature Immunology)
图丨Nature Immunology 当期封面(来源:Nature Immunology)
最近,浙江大学医学院/良渚实验室/浙江大学医学院附属第一医院张进教授团队通过系列研究,以巨噬细胞为切入点,从不同方面为解决针对实体肿瘤的免疫治疗提供了新的解决方案。
研究人员开发出第二代抗原依赖性 M1 极化的 CAR-巨噬细胞(chimeric antigen receptor–macrophage,CAR-iMac),并证明巨噬细胞除了能够以类似 CAR-T 的抗原依赖性方式进行靶向杀伤之外,还能够在肿瘤细胞吞噬后,像树突状细胞(dendritic cell,DC)一样,通过将肿瘤内部抗原提呈的方式刺激 T 细胞,从而让 T 细胞接过“接力棒”,进一步对肿瘤细胞进行非抗原依赖性杀伤。
 图丨相关论文(来源:Nature Immunology)
图丨相关论文(来源:Nature Immunology)
近日,相关论文以《第二代 M1 极化的 CAR-巨噬细胞》(A second generation M1-polarized CAR macrophage with antitumor efficacy)为题,以封面论文形式发表在 Nature Immunology[1]。
论文共同第一作者为浙江大学医学院博士后/助理研究员雷安华以及浙江大学博士后余华(现为南昌大学特聘教授),通讯作者为浙江大学张进教授。

有望实现更好的实体肿瘤治疗效果
那么,二代的 CAR-iMac 与一代有何区别呢?第一代 CAR-iMac 设计的方法是 CAR 胞内只有一个促进杀伤的胞内结构域。类比第一代的 CAR-T,因 CAR 设计中仅有一个促进T细胞杀伤的胞内结构域,在临床上疗效并不理想。
第二代的 CAR-T 设计则增加了促进其持久性的 CD28 或 41BB 胞内结构域,在临床上达到了优异的疗效 。第二代 CAR-iMac 将促进巨噬细胞吞噬杀伤和促炎极化的两个胞内结构域进行串联,从而提供正交的双重信号,有效地增强了 CAR-iMac 的抗肿瘤功能。
2020 年,张进课题组与美国宾夕法尼亚大学卡尔·朱恩(Carl June)课题组,分别用不同的手段开发了第一代巨噬细胞,当时两个团队的设计都是胞内只有刺激巨噬细胞吞噬杀伤的结构域。
其中,前者的细胞来源为诱导性多能干细胞(induced pluripotent stem cell,iPSC),而后者的细胞来源是外周血单核细胞。
巨噬细胞独特的特点之一,是需要变成 M1 型的促炎极化状态,而该状态可以促进从冷肿瘤微环境变成热肿瘤微环境。
研究人员进行大量的筛选,最终发现将 TLR4 与 CD3 胞内结构域串联到 CAR 之后,巨噬细胞同时具有吞噬杀伤和促炎极化两方面的特点。
“我们在动物模型中验证了其具有更好的疗效,我们相信,在后续的临床试验中,很可能与 CAR-T 细胞的迭代发展类似,第二代展现出更好的治疗效果。”张进表示。
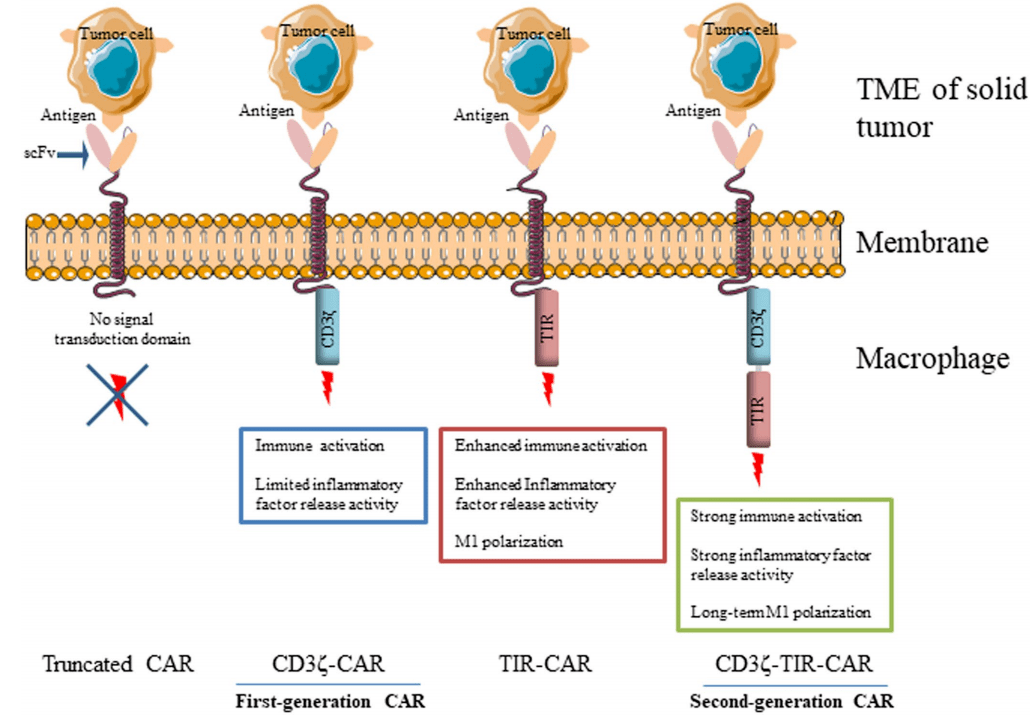 图丨第一代和第二代的巨噬细胞 CAR(来源:Nature Immunology)
图丨第一代和第二代的巨噬细胞 CAR(来源:Nature Immunology)
第二代 CAR-iMac 设计有望助力科研人员设计相关临床试验,对其杀伤作用机制进行深入了解后,根据相关机制进行更加合理的临床设计。
例如研究人员发现,CAR-iMac 是通过诱导肿瘤细胞凋亡,再吞噬凋亡碎片的方式,杀灭肿瘤细胞的。这一过程也被形象的成为“胞葬”作用 (efferocytosis)。
基于这一机制,通过设计与化疗或放疗的联用,来诱导更多的凋亡碎片,有望实现更好的实体肿瘤治疗效果。
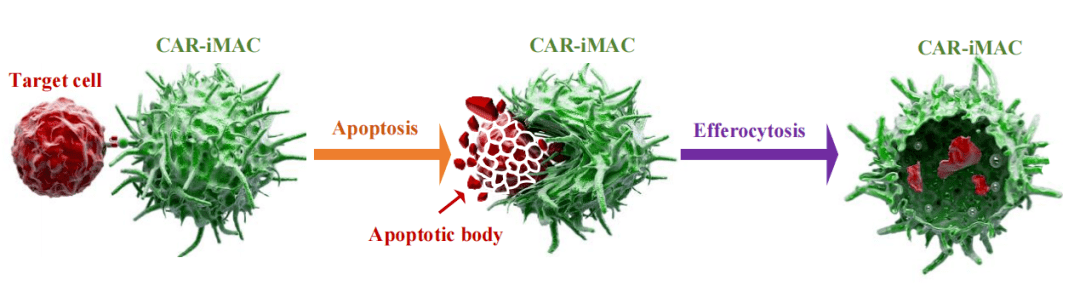 图丨第二代 CAR-iMAC 通过“胞葬”作用清除肿瘤细胞(来源:该团队)
图丨第二代 CAR-iMAC 通过“胞葬”作用清除肿瘤细胞(来源:该团队)
事实上,髓系树突状细胞(DC 细胞)药物 Provenge 作为肿瘤疫苗,已经获批 10 多年,但由于当时技术水平有限,并没有对其进行任何有效的基因编辑。
而现在利用 iPSC 来源的巨噬/DC 细胞平台,基因编辑效率可达 90% 左右,能够在对该细胞进行更好的工程化改造后,赋予其特异性及增强其他方面的功能。因此张进认为,该技术可能会对整个巨噬细胞免疫治疗或 DC 细胞免疫治疗的应用产生深远的影响。
由于髓系细胞和巨噬细胞在人体各个组织中广泛存在,因此当其被基因编辑后,作为一种工程化的细胞发挥治疗作用的手段,有望被推广和应用到涉及到巨噬细胞的(包括自身免疫病在内的)多种疾病中,为相关疾病提供新的治疗思路。

帮助巨噬细胞躲过肿瘤细胞的“糖衣炮弹”
这些基因编辑的手段,除了用于直接在 CAR 上“做文章”以外,也可以用于对 iMac 的其他功能进行编辑,从而克服实体肿瘤治疗中面临的另一巨大挑战:实体肿瘤中存在非常不利于免疫细胞发挥作用的微环境。
为解决该问题,研究人员提供了两种解决方案。巨噬细胞与代谢密切相关,在肿瘤微环境中,其通常容易转变为促进肿瘤发展的 M2 状态。
他们 2023 年 10 月发表在 Nature Communications 的论文中[2],通过 CRISPR 进行 3000 个代谢基因的遗传筛选后,确定 ACOD1 是巨噬细胞促炎极化状态的强调节因子。
当将该基因敲除后,不但巨噬细胞能够变得像 M1 促炎极化的类型,还可以长时间对抗肿瘤细胞,而不变成 M2 类型。研究人员在小鼠模型中,观察到 CAR-iMac 长达 2 周保持在 M1 的状态,不会被免疫抑制的微环境逆转。
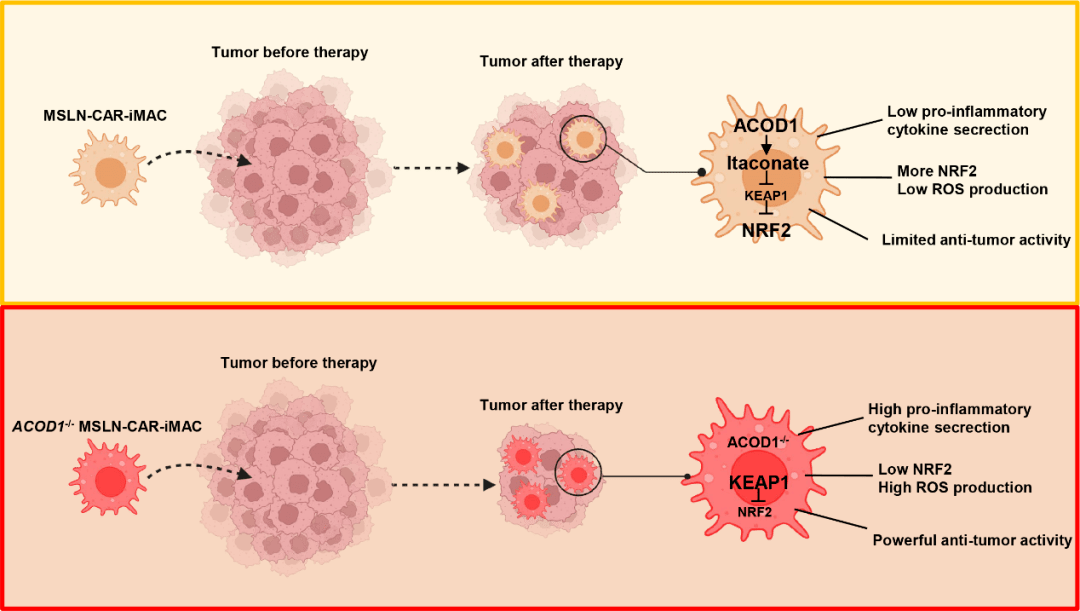 (来源:Nature Communications)
(来源:Nature Communications)
此外,在肿瘤微环境中,很多肿瘤细胞的表面会发生糖基化,其与巨噬细胞上的受体会发生相互作用,进而通过抑制巨噬细胞功能将其“骗过”,也即肿瘤细胞的“不要吃我”信号。
在该课题组与浙江大学王本教授课题组 2023 年 10 月发表在 PNAS 的论文中[3],研究人员发现,CAR-iMac 和能够水解糖基化的唾液酸酶的联合能够明显使 CAR-iMac 对抗实体瘤的能力增强。
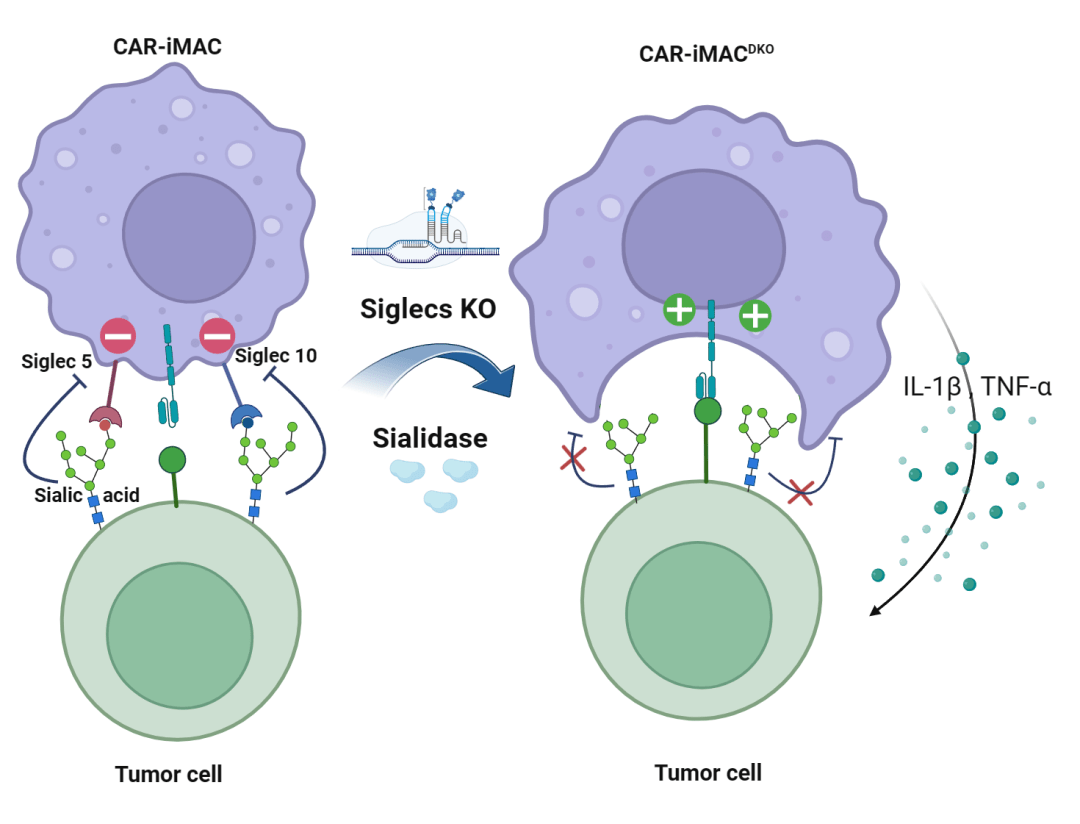 (来源:PNAS)
(来源:PNAS)
研究人员还发现,在巨噬细胞接触到肿瘤细胞后,Siglec-5和 Siglec-10 是被诱导出来最明显的两个糖基化的受体分子,介导了抑制巨噬细胞的作用。于是,他们通过基因编辑手段同时敲除这两个分子,以帮助巨噬细胞不被肿瘤细胞的“糖衣炮弹”所影响。

未来布局巨噬细胞在体编辑系统
张进团队的主要研究方向是将工程化干细胞来源的免疫细胞用于免疫治疗。多年来,在原始创新以及转化应用方面开展了系统性的工作。
并且,他们还与赛元生物合作,共同建立了巨噬细胞 iMac(iPSC 来源的巨噬细胞)、eMAC(Edited MAC)、CAR-MAC、V-MAC 等主要研发与工艺技术平台。
提到 V-MAC,张进介绍道:“这是我们最近开发出来的一个基于脂质纳米颗粒(Lipid Nanoparticle,LNP)-mRNA 递送和在体巨噬/DC 细胞编辑的崭新的平台。在体(in vivo)编辑技术与经典的体外(ex vivo)免疫细胞编辑进而回输的方式比较起来,具有各自的优势。”
值得关注的是,LNP 这种递送载体,在没有抗体修饰的情况下,绝大部分会天然的进入具有吞噬功能的髓系免疫细胞比如巨噬细胞和 DC 细胞,而不太会进入 T 细胞和自然杀伤细胞。
基于 LNP-mRNA 的新冠或者肿瘤疫苗,也正是通过进入 DC 细胞来发挥作用的。因此,髓系细胞是通过 LNP-mRNA 进行免疫细胞在体编辑的最佳对象。基于此,他们开发了这一技术平台 V-MAC 并将其应用于实体肿瘤等多种类型疾病的治疗。
 图丨张进课题组(来源:张进)
图丨张进课题组(来源:张进)
未来,该团队计划“三步走”,即朝着“更深入、更聚焦、更开放”的方向继续开展研究。第一,“更深入”,即利用 CAR-巨噬细胞相关技术平台的优势来解决实体肿瘤的异质性的问题,以及促进微环境从冷肿瘤向热肿瘤转变。
“对于后者,我们现在已经有比较好的解决方案,前者还需要未来更多的深入的研究。”张进说。
第二,“更聚焦”。该课题组目前在临床前的数据已经非常详实,为临床研究奠定了良好的基础。他们的目标是充分结合巨噬细胞自身的特性,聚焦于 1-2 个临床上缺乏治疗药物的实体肿瘤适应症,积极向临床应用推进。
第三,“更开放”。目前,很多自身免疫疾病(例如系统性红斑狼疮)在临床上也有巨大的未满足的医学需求,为此,他们开发了将巨噬细胞转变为 M2 型抑炎巨噬细胞的新产品。
此外,在治疗炎性疾病、纤维化、神经退行性疾病方面工程化巨噬细胞也大有用武之地,他们希望将已经建立的系统开放共享,通过与临床、产业方面的专家合作,通过不断的研究与转化工作,为更多的患者带来具有临床受益并且安全的治疗方案。
参考资料:
1.Lei, A.,Yu, H., et al.A second-generation M1-polarized CAR macrophage with antitumor efficacy. Nature Immunology (2023). https://www.nature.com/articles/s41590-023-01687-8
2.Wang, X., Su, S., Zhu, Y. et al. Metabolic Reprogramming via ACOD1 depletion enhances function of human induced pluripotent stem cell-derived CAR-macrophages in solid tumors. Nature Communications 14, 5778 (2023). https://doi.org/10.1038/s41467-023-41470-9
3.Wu,J.,etal. Targeted glycan degradation potentiates cellular immunotherapy for solid tumors.Proceedings of the National Academy of Sciences of the United States of America 120 38,e2300366120(2023).
https://doi.org/10.1073/pnas.2300366120
